Ciclo y teorema de Carnot
¿Qué es el teorema y ciclo de Carnot?
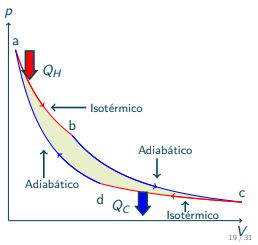
Es un proceso reversible el
cual consiste de:
- El gas se expande isotérmicamente a temperatura TH , absorbiendo calor QH (ab).
- El gas se expande adiabáticamente hasta que su temperatura baja a TC (bc).
- El gas se comprime isotérmicamente a TC , expulsando calor.
- El gas se comprime adiabáticamente hasta su estado inicial a temperatura TH.
¿Qué es la maquina de Carnot?
Es una máquina idealizada que cumple con el ciclo de Carnot y es la máquina térmica con la eficiencia máxima posible de acuerdo con la segunda Ley de la Termodinámica.
La eficiencia de una máquina de Carnot se determina
La ecuación anterior expresa la eficiencia de una máquina de Carnot y establece un límite superior para la eficiencia de una máquina real, como una turbina de vapor.
Dado que cada paso del ciclo de Carnot es reversible, todo el ciclo podría revertirse, convirtiendo la máquina en refrigerador. El coeficiente de rendimiento del refrigerador de Carnot se obtiene combinando la definición general de K:
¿Cuál es la entropía?
La entropía es una propiedad que indica la dirección natural de un proceso. El concepto de entropía tiene muchas interpretaciones físicas diferentes entre las que están.
- La entropía es una medida del desorden.
- La entropía es una medida de la capacidad que tiene un sistema para realizar trabajo útil.
- La entropía determina la dirección del tiempo.
El cambio de entropía de un proceso se puede determinar:
Enunciados de la segunda ley de la termodinámica (Clausius y Kelvin - Planck)
¿A qué se refieren los enunciados de la segunda ley de la termodinámica (Clausius y Kelvin-Planck)?
Definición de Kelvin-Planck: “Es imposible construir un aparato que opere cíclicamente, cuyo único efecto sea absorber calor de una fuente de temperatura y convertirlo en una cantidad equivalente de trabajo”.
Definición de Clausius: “Es imposible construir un aparato que opere en un ciclo cuyo único efecto sea transferir calor desde una fuente de baja temperatura a otra de temperatura mayor”.
Procesos reversibles e irreversibles
¿Qué es un proceso reversible?
Reversible: es un proceso que, una vez que ha tenido lugar, puede ser invertido (recorrido en sentido contrario) sin causar cambios ni en el sistema ni en sus alrededores.
¿Qué son los procesos irreversibles
Es un proceso que no es reversible. Los estados intermedios de la transformación no son de equilibrio.
Aplicaciones del segundo principio de la termodinámica
- Un gas comprimido tiende a expandirse.
- La transferencia de calor siempre sucede desde los cuerpos calientes a los fríos.
- El funcionamiento de un aire acondicionado.
Tercera Ley de la Termodinámica
¿Qué es la escala Kelvin y el cero absoluto?
Escala Kelvin: La escala Kelvin se basa en la medida de la temperatura termodinámica, esto es, la medición de la temperatura absoluta de un objeto. La base sobre la que se asienta la escala es la temperatura de cero absoluto, que representaría la total ausencia de energía en forma de calor de un objeto, lo que en grados centígrados supondría una temperatura de -273,15 grados.
se la considera como la escala absoluta de medición de temperatura, y es la que se emplea en cualquier trabajo o estudio químico o científico. La escala Kelvin propone un modelo sin valores negativos, en el que el cero corresponde con el cero absoluto, es decir, no habrá nada que pudiera estar más «frío» que esto, aunque en realidad no hablamos de frío o calor, sino de ausencia o no de energía termodinámica.
Cero absoluto: El cero absoluto es la temperatura teórica más fría, a la cual el movimiento térmico de los átomos y las moléculas alcanza su mínimo. Este es un estado en el que la entalpía y la entropía de un gas ideal enfriado alcanza su valor mínimo, tomado como 0.
Matemáticamente:
lim S T → 0 = 0
dónde
S = entropía (J / K)
T = temperatura absoluta (K)
Clásicamente , este sería un estado de inmovilidad , pero la incertidumbre cuántica dicta que las partículas todavía poseen una energía finita de punto cero . El cero absoluto se denota como 0 K en la escala Kelvin, −273.15 ° C en la escala Celsius y −459.67 ° F en la escala Fahrenheit.
¿Qué es el calor especifico en temperaturas bajas?
El calor específico es la cantidad
de calor que se necesita por unidad de masa para elevar la temperatura un grado
Celsius. La relación entre calor y cambio de temperatura se expresa normalmente
en la forma que se muestra abajo, donde c es el calor específico. Esta fórmula
no se aplica si se produce un cambio de fase, porque el calor añadido o sustraído
durante el cambio de fase no cambia la temperatura.
Postulados de Nernst, de Nernst-Simón y de Planck
¿A qué se refieren los Postulados de Nernst, de Nernst - Simón y de Planck?
Postulado de Nertnst: Es imposible para cualquier proceso, sin importar cuán idealizado esté, reducir la entropía de un sistema a su valor de cero absoluto en un número finito de operaciones.
Matemáticamente:
El teorema del calor de Nernst fue utilizado más tarde por un físico alemán Max Planck para definir la tercera ley de la termodinámica en términos de entropía y cero absoluto. Algunos materiales (por ejemplo, cualquier sólido amorfo) no tienen un orden bien definido en cero absoluto. En estos materiales (p. Ej., Vidrio), la entropía finita también permanece en cero absoluto, porque la estructura microscópica del sistema (átomo por átomo) se puede organizar de diferentes maneras (W ≠ 1). Esta entropía constante se conoce como entropía residual, que es la diferencia entre un estado de no equilibrio y el estado cristalino de una sustancia cercana al cero absoluto.
Tenga en cuenta que la definición exacta de entropía es:
Entropía = (constante de Boltzmann k) x logaritmo del número de estados posibles
Postulado de Nernst-Simon: “En cualquier proceso isotérmico que implique sustancias en equilibrio interno, la variación de entropía tiende a cero cuando T tiende a cero”.
Postulados de Planck: “La entropía de todo cuerpo, químicamente puro, perfectamente cristalizado y de densidad finita, en equilibrio termodinámico, es nula en el cero absoluto”.
Referencias
-Segunda Ley de la Termodinámica del Físico Carlos Adrián Jiménez Carballo Escuela de Física Instituto Tecnológico de Costa Rica
https://repositoriotec.tec.ac.cr/bitstream/handle/2238/10186/Segunda%20Ley%20Termodinamica.pdf?sequence=1&isAllowed=y#:~:text=Una%20m%C3%A1quina%20t%C3%A9rmica%20toma%20calor,TH%20(aire%20del%20exterior)
-Fenómenos de transporte Segunda ley de la termodinámica
http://www.unet.edu.ve/~fenomeno/F_DE_T-75.htm
Segunda Ley de la Termodinámica
https://www.fisicalab.com/apartado/segundo-principio-termo
Máquinas térmicas y segunda ley de la termodinámica
https://www.monografias.com/trabajos104/maquinas-termicas-y-segunda-ley-termodinamica/maquinas-termicas-y-segunda-ley-termodinamica.shtml
Maquinas térmicas y refrigeradores
https://www.calculisto.com/topics/termodinamica/summary/292











Interesante información, desconocia el uso del segundo del segundo principio de la termodinamica en los tanques de gas.
ResponderEliminar